Química de la fabricación de jabón natural
Un cliente, que es profesor de ciencias de secundaria y también se dedica a la fabricación de jabón, me preguntó si podía explicar la química de la fabricación de jabón de una manera detallada pero sencilla.
Por supuesto, pensé que sería una gran idea tener un blog.
No es necesario que comprendas la ciencia detrás de tu pastilla de jabón.

Sin embargo, una mirada en profundidad al proceso de fabricación del jabón puede ayudarle a entender por qué una barra de jabón hecha a mano y procesada en frío es una opción excepcional para su piel.
Si te remontas a tus días de química en la preparatoria, quizás recuerdes haber aprendido sobre las reacciones ácido-base. Cuando un ácido y una base se combinan, se neutralizan mutuamente y forman una sal.
En términos simples, la saponificación es el nombre de una reacción química entre un ácido y una base para formar una sal llamada "jabón".
Expliqué la versión simple de la saponificación en nuestro blog titulado " ¿Hay lejía en el jabón natural? ¿No dañará mi piel?".
Profundicemos en la química de la fabricación de jabón.
El hidróxido de sodio es el álcali (base) y los ácidos son los ácidos grasos que componen los triglicéridos presentes en aceites y mantequillas. Cuando el ácido graso y el hidróxido de sodio (lejía) se combinan, se neutralizan mutuamente y forman una sal llamada jabón.
Comencemos analizando la estructura química de las grasas (aceites).

A la izquierda del gráfico se ve la estructura de una molécula de glicerol . Esta molécula es siempre la misma en todas las moléculas de grasa (triglicéridos). Cada "O" negra en la molécula de glicerol representa un átomo de oxígeno. Observe que hay tres, cada uno unido a un ácido graso (líneas en zigzag a la derecha).
En el dibujo, muestro tres ácidos grasos de diferente aspecto unidos a la molécula de glicerol. Los ácidos grasos pueden ser idénticos o una mezcla de diferentes tipos; el único requisito es que sean tres. Esta variabilidad permite una amplia gama de posibles combinaciones de triglicéridos, lo que a su vez afecta las características de la pastilla de jabón final.
Las grasas y los aceites se llaman triglicéridos porque son tres (tri) ácidos grasos unidos a una molécula de glicerina. Imagine la molécula de glicerol como el tronco de un árbol y los ácidos grasos como sus tres ramas.
Ácidos grasos y fabricación de jabón
Es difícil imaginar un ácido graso porque no podemos verlo. Existen dos tipos principales de ácidos grasos: saturados e insaturados. Seguramente has oído hablar de ellos en relación con la nutrición, y son extremadamente importantes para determinar las cualidades de una pastilla de jabón.
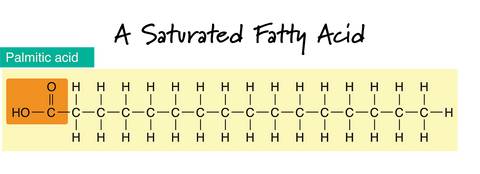
En el dibujo de un ácido graso saturado, las líneas discontinuas "-" entre los átomos de carbono (C) representan un enlace simple. Observe que la cadena carbonada es recta y que solo existen enlaces simples entre los átomos de carbono. Si solo existen enlaces simples entre los carbonos vecinos en la cadena de hidrocarburos, se dice que un ácido graso está saturado.
Las grasas saturadas también tienden a ser sólidas a temperatura ambiente. Esto tiene sentido si se imagina cómo se apilan perfectamente. Las grasas y aceites con niveles más altos de grasas saturadas añaden dureza a una pastilla de jabón. Suelen ser también los aceites responsables de la espuma burbujeante. Los cuatro ácidos grasos saturados más comunes presentes en los aceites para hacer jabón son el mirístico, el láurico, el esteárico y el palmítico.

Observe que en el ácido graso insaturado la cadena carbonada ya no es recta y ahora hay líneas discontinuas dobles "=" entre algunos átomos de carbono. Estas líneas discontinuas dobles (que parecen signos de igual) se denominan "dobles enlaces". Cuando la cadena de hidrocarburos de un ácido graso tiene al menos un doble enlace, el ácido graso ya no está saturado porque contiene menos átomos de hidrógeno.
Las grasas con un solo doble enlace se denominan monoinsaturadas , como el aceite de oliva. Las grasas con muchos dobles enlaces se denominan poliinsaturadas, como los aceites de cártamo y girasol.
Las grasas insaturadas suelen ser de origen vegetal y, dado que sus moléculas no se compactan perfectamente, suelen ser líquidas a temperatura ambiente. Estos ácidos grasos aportan cremosidad a la espuma y propiedades acondicionadoras al jabón. Los cuatro ácidos grasos insaturados más comunes presentes en los aceites para la elaboración de jabón son el oleico, el linoleico, el linolénico y el ricinoleico.
Descifrando la ciencia de la saponificación
La palabra saponificación proviene de dos vocablos latinos: «sapo», que significa «jabón», y «facere», que significa «hacer». Esta reacción química es la base de la fabricación del jabón.
Como se ilustra en el gráfico de la reacción de saponificación, hay una molécula de triglicérido (grasa), que está compuesta de tres ácidos grasos (indicados por la "R" en el círculo verde).
Dado que cada ácido graso necesita reaccionar con una molécula de hidróxido de sodio (NaOH), se necesitan 3 moléculas de NaOH (lejía) por cada triglicérido. Al elaborar jabón líquido, se utiliza una base o álcali diferente, llamada hidróxido de potasio (KOH), en lugar de NaOH.
Aunque no se muestra en el diagrama, la reacción de saponificación también produce un poco de agua junto con la glicerina y el jabón, pero a medida que el jabón se cura, gran parte del agua se evapora.  La ecuación básica para la saponificación se puede escribir como:
La ecuación básica para la saponificación se puede escribir como:
Triglicérido (grasa/aceite) + hidróxido de sodio (NaOH) → glicerol + jabón (sal sódica de ácido graso)
Aunque el agua no participa en la reacción de saponificación, desempeña un papel crucial. El hidróxido de sodio debe disolverse en un líquido acuoso para que se produzca la reacción. No existe una relación fija entre la cantidad de moléculas de agua necesarias; simplemente se utiliza para disolver el hidróxido de sodio y que pueda reaccionar con el aceite. Aunque el líquido típico utilizado en la mayoría de los jabones es agua, se pueden utilizar otros líquidos como leche o jugos.
La primera parte del proceso de elaboración del jabón comienza cuando el NaOH se disuelve en agua, disociándose en iones de sodio (Na+) e iones de hidróxido (OH-). Esta reacción es exotérmica, lo que significa que libera calor.
Los resultados de la reacción de saponificación
Una vez que se agrega la solución de hidróxido de sodio (lejía) a las grasas, las 3 altamente reactivas Los iones (OH) del 3NaOH rompen los 3 enlaces éster en el triglicérido, lo que lleva a la formación de una molécula de glicerol libre (glicerina).
Mientras tanto, cada uno de los 3 iones de sodio (Na) se empareja con un ácido graso para formar 3 sales de ácidos grasos, esencialmente 3 moléculas de jabón.
 En términos simples, cuando combinamos grasas o aceites con hidróxido de sodio (lejía), se transforman en jabón y glicerina. Observe nuevamente la gráfica de la reacción de saponificación y notará que a partir de cada triglicérido se forman una molécula de glicerina y tres moléculas de jabón .
En términos simples, cuando combinamos grasas o aceites con hidróxido de sodio (lejía), se transforman en jabón y glicerina. Observe nuevamente la gráfica de la reacción de saponificación y notará que a partir de cada triglicérido se forman una molécula de glicerina y tres moléculas de jabón .
Nota al margen: Es posible que te encuentres con los términos glicerol, glicerina o glicerina. se usan indistintamente. No te preocupes, todos se refieren al mismo compuesto y No existe diferencia química entre ellos. El nombre común del glicerol es, de hecho, glicerina.
La glicerina producida en cada reacción de elaboración de jabón es siempre la misma. La glicerina, un humectante y humectante, se suele extraer del jabón comercial para endurecer las pastillas, pero toda su bondad se conserva en el jabón artesanal.
La verdadera magia ocurre con las tres moléculas de jabón, cada una con su composición única de ácidos grasos.
 Esta reacción no se limita a una molécula de triglicérido, sino que ocurre con cada molécula de una mezcla de grasa y aceite.
Esta reacción no se limita a una molécula de triglicérido, sino que ocurre con cada molécula de una mezcla de grasa y aceite.
Millones y millones de moléculas de triglicéridos producen millones y millones de moléculas de jabón, cada una de las cuales aporta sus propiedades distintivas a la barra de jabón final.
A primera vista, la reacción de saponificación parece sencilla: basta con mezclar aceites y lejía. Pero la ciencia es más compleja.
Cada aceite se compone de diferentes tipos de ácidos grasos en porcentajes variables. Dependiendo de los tipos de ácidos grasos presentes, el jabón resultante tendrá propiedades muy diferentes. Esta complejidad es lo que convierte la elaboración de jabón en una ciencia precisa que requiere un profundo conocimiento de los ingredientes y sus interacciones.
Para crear jabones excepcionales, es esencial una combinación cuidadosa de aceites con diversos perfiles de ácidos grasos.
Aunque se conocen cientos de ácidos grasos, los fabricantes de jabón necesitan comprender principalmente las propiedades de unos ocho ácidos grasos clave. Los cuatro ácidos grasos saturados provienen principalmente de aceites sólidos a temperatura ambiente, entre ellos los ácidos mirístico, láurico, palmítico y esteárico.
- El ácido mirístico , presente en los aceites de coco y de palmiste, contribuye a la dureza, la limpieza y la formación de espuma.
- El ácido láurico, que también se encuentra en los aceites de coco y de palmiste, contribuye a que se formen burbujas grandes.
- El ácido palmítico , que se encuentra en el aceite de palma y la manteca de cacao, ayuda a crear una barra de jabón dura con una espuma estable y cremosa.
- El ácido esteárico, presente en mantecas sólidas como la de karité, mango y cacao, también se encuentra en el aceite de palma y el sebo de res. Este ácido también ayuda a crear una pastilla de jabón firme con espuma estable.
Los cuatro ácidos grasos insaturados provienen de aceites vegetales, generalmente líquidos a temperatura ambiente. Entre ellos se encuentran el oleico, el linoleico, el linolénico y el ricinoleico.
- El ácido oleico, más conocido por su contenido en aceite de oliva pero también presente en otros aceites como el de canola, añade propiedades hidratantes y acondicionadoras al jabón.
- El ácido linoleico, que se encuentra en mayor abundancia en los aceites de girasol, cártamo y semilla de uva, también aporta propiedades hidratantes y acondicionadoras.
- El ácido linolénico, presente en los aceites de linaza, granada y algunos otros aceites de semillas, aporta propiedades hidratantes y acondicionadoras.
-
El ricinoleico, presente únicamente en el aceite de ricino, aporta propiedades hidratantes al jabón. Pero lo más importante es que crea una espuma increíblemente densa, cremosa y burbujeante. Gracias a su composición única de ácidos grasos, no hay otro aceite que se le compare.
Conclusión
La saponificación es el resultado de una reacción ácido-base. Cuando un ácido y una base se combinan, se neutralizan mutuamente y forman una sal. El hidróxido de sodio es el álcali (base) y los ácidos son los ácidos grasos que componen los triglicéridos presentes en aceites y mantequillas.
Una vez que seleccionamos los aceites y los mezclamos con hidróxido de sodio y un líquido, las moléculas se combinan, se produce una reacción química, llamada saponificación (en la imagen de abajo) , y se crea una sustancia totalmente diferente: jabón más glicerina.
 No es necesario ser un experto en química para usar o fabricar jabón, pero tener una comprensión más profunda de la ciencia detrás del mismo puede mejorar la experiencia.
No es necesario ser un experto en química para usar o fabricar jabón, pero tener una comprensión más profunda de la ciencia detrás del mismo puede mejorar la experiencia.
Así como un chef experto sabe que dominar el arte de cocinar implica tanto creatividad como un conocimiento de la química subyacente de los alimentos, un hábil fabricante de jabón reconoce la importancia de comprender la ciencia de la saponificación.
Si bien seguir una receta puede dar buenos resultados, un jabón artesanal verdaderamente excepcional requiere un enfoque meticuloso para seleccionar y equilibrar las grasas y aceites adecuados. Al comprender la química que regula la interacción de estos ingredientes con la lejía, los jaboneros pueden crear barras de alta calidad que nutren y deleitan la piel.
Ahora es el momento de encontrar el jabón orgánico perfecto para ti.

¿El jabón natural contiene lejía? ¿No dañará mi piel?
¿Cómo crea espuma el jabón natural?
Cómo fabricamos jabón en Chagrin Valley
12 razones para usar jabón natural
¿Son todos los jabones hechos a mano iguales?






