Chemie der Naturseifenherstellung
Ein Kunde, der Naturwissenschaftslehrer an einer Mittelschule ist und sich auch mit der Seifenherstellung beschäftigt, fragte mich, ob ich die Chemie der Seifenherstellung ausführlich, aber einfach erklären könnte.
Natürlich dachte ich, was für eine großartige Idee für einen Blog.
Sie müssen die Wissenschaft hinter Ihrem Stück Seife nicht verstehen.

Ein genauerer Blick auf den Seifenherstellungsprozess kann Ihnen jedoch helfen zu verstehen, warum ein kalt verarbeitetes, handgemachtes Stück Seife eine außergewöhnliche Wahl für Ihre Haut ist.
Wenn Sie sich noch einmal an Ihren Chemieunterricht in der Schule erinnern, werden Sie sich vielleicht an Säure-Base-Reaktionen erinnern. Wenn sich eine Säure und eine Base verbinden, neutralisieren sie sich gegenseitig und bilden ein Salz.
Vereinfacht ausgedrückt ist Verseifung die Bezeichnung für eine chemische Reaktion zwischen einer Säure und einer Base, bei der ein Salz namens „Seife“ entsteht.
Ich habe die einfache Version der Verseifung in unserem Blog mit dem Titel „ Ist in Naturseife Lauge enthalten? Schadet das nicht meiner Haut?“ erklärt.
Lassen Sie uns tiefer in die Chemie der Seifenherstellung eintauchen
Natriumhydroxid ist die Base und die Säuren sind die Fettsäuren, aus denen die in Ölen und Butter enthaltenen Triglyceride bestehen. Wenn sich die Fettsäure und das Natriumhydroxid (Lauge) verbinden, neutralisieren sie sich gegenseitig und bilden ein Salz, das wir Seife nennen.
Beginnen wir mit der Erörterung der chemischen Struktur von Fetten (Ölen).

Auf der linken Seite der Grafik sehen Sie das Rückgrat eines Glycerinmoleküls . Dieses Molekül ist in jedem Fettmolekül (Triglycerid) gleich. Jedes schwarze „O“ im Glycerinmolekül steht für ein Sauerstoffatom. Beachten Sie, dass es drei davon gibt, die jeweils an eine Fettsäure gebunden sind (die Zickzacklinien rechts).
In der Zeichnung zeige ich drei unterschiedlich aussehende Fettsäuren, die an das Glycerinmolekül gebunden sind. Die Fettsäuren können alle identisch oder eine Mischung verschiedener Typen sein – Voraussetzung ist lediglich, dass drei davon vorhanden sind. Diese Variabilität ermöglicht eine große Bandbreite möglicher Triglyceridkombinationen, die wiederum die Eigenschaften des fertigen Seifenstücks beeinflussen.
Fette und Öle werden Triglyceride genannt, da drei (Tri-)Fettsäuren an ein Glycerinmolekül gebunden sind. Stellen Sie sich das Glycerinmolekül wie einen Baumstamm vor, und die Fettsäuren sind seine drei Äste.
Fettsäuren und Seifenherstellung
Es ist schwierig, sich eine Fettsäure vorzustellen, da wir sie nicht sehen können. Es gibt zwei Hauptarten von Fettsäuren: gesättigte und ungesättigte. Sie haben sicherlich schon von diesen im Zusammenhang mit der Ernährung gehört, und sie sind äußerst wichtig für die Eigenschaften eines Stücks Seife.
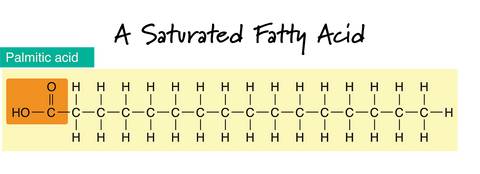
In der Zeichnung einer gesättigten Fettsäure stellen die gestrichelten „-“-Linien zwischen den Kohlenstoffatomen (C) eine Einfachbindung dar. Beachten Sie, dass die Kohlenstoffkette gerade ist und nur Einfachbindungen zwischen den Kohlenstoffatomen bestehen. Wenn in der Kohlenwasserstoffkette nur Einfachbindungen zwischen benachbarten Kohlenstoffatomen bestehen, spricht man von einer gesättigten Fettsäure.
Gesättigte Fette sind bei Raumtemperatur meist fest. Das ist verständlich, wenn man sich vorstellt, wie sie sich aneinander stapeln. Fette und Öle mit einem höheren Anteil gesättigter Fette verleihen einem Stück Seife Härte. Sie sind in der Regel auch für den Schaum verantwortlich. Die vier häufigsten gesättigten Fettsäuren in Seifenölen sind Myristin-, Laurin-, Stearin- und Palmitinsäure.

Beachten Sie, dass die Kohlenstoffkette der ungesättigten Fettsäure nicht mehr gerade ist und zwischen einigen Kohlenstoffatomen doppelte Strichlinien „=“ vorhanden sind. Diese doppelten Strichlinien (die wie Gleichheitszeichen aussehen) werden als „Doppelbindungen“ bezeichnet. Wenn die Kohlenwasserstoffkette einer Fettsäure mindestens eine Doppelbindung aufweist, ist die Fettsäure nicht mehr gesättigt, da sie weniger Wasserstoffatome enthält.
Fette mit einer einzigen Doppelbindung werden als einfach ungesättigt bezeichnet, wie beispielsweise Olivenöl. Fette mit vielen Doppelbindungen werden als mehrfach ungesättigt bezeichnet, wie beispielsweise Distel- und Sonnenblumenöl.
Ungesättigte Fette stammen meist aus pflanzlichen Quellen und sind bei Raumtemperatur meist flüssig, da ihre Moleküle nicht gleichmäßig angeordnet sind. Diese Fettsäuren verleihen dem Schaum Cremigkeit und der Seife pflegende Eigenschaften. Die vier häufigsten ungesättigten Fettsäuren in Seifenölen sind Ölsäure, Linolsäure, Linolensäure und Ricinolsäure.
Die Wissenschaft der Verseifung entschlüsseln
Das Wort Verseifung setzt sich aus den beiden lateinischen Wörtern „sapo“ (Seife) und „facere“ (machen) zusammen. Diese chemische Reaktion ist die Grundlage der Seifenherstellung.
Wie in der Grafik der Verseifungsreaktion dargestellt, gibt es ein Triglyceridmolekül (Fettmolekül), das aus drei Fettsäuren besteht (angezeigt durch das „R“ im grünen Kreis).
Da jede Fettsäure mit einem Molekül Natriumhydroxid (NaOH) reagieren muss, benötigt man für jedes Triglycerid drei Moleküle NaOH (Lauge). Bei der Herstellung von Flüssigseife wird anstelle von NaOH eine andere Base oder Lauge namens Kaliumhydroxid (KOH) verwendet.
Obwohl es im Diagramm nicht dargestellt ist, entsteht bei der Verseifungsreaktion neben Glycerin und Seife auch etwas Wasser, doch während die Seife aushärtet, verdunstet ein Großteil des Wassers.  Die Grundgleichung für die Verseifung kann wie folgt geschrieben werden:
Die Grundgleichung für die Verseifung kann wie folgt geschrieben werden:
Triglycerid (Fett/Öl) + Natriumhydroxid (NaOH) → Glycerin + Seife (Natriumsalz der Fettsäure)
Obwohl Wasser bei der Verseifungsreaktion nicht vorkommt, spielt es eine entscheidende Rolle. Damit die Reaktion stattfinden kann, muss das Natriumhydroxid in einer wasserbasierten Flüssigkeit gelöst werden. Es gibt keine feste Beziehung zwischen der Anzahl der benötigten Wassermoleküle; es dient lediglich dazu, das Natriumhydroxid zu lösen, damit es mit dem Öl reagieren kann. Während die typische Flüssigkeit, die in den meisten Seifen verwendet wird, Wasser ist, können auch andere Flüssigkeiten wie Milch oder Säfte verwendet werden.
Der erste Teil des Seifenherstellungsprozesses beginnt mit der Auflösung von NaOH in Wasser. Dabei werden Natriumionen (Na+) und Hydroxidionen (OH-) gebildet. Diese Reaktion ist exotherm, das heißt, sie setzt Wärme frei.
Die Ergebnisse der Verseifungsreaktion
Sobald die Natriumhydroxidlösung (Lauge) zu den Fetten hinzugefügt wird, werden die 3 hochreaktiven (OH)-Ionen aus dem 3NaOH brechen die 3 Esterbindungen im Triglycerid auf, was zur Bildung eines freien Glycerinmoleküls (Glycerin) führt.
In der Zwischenzeit paart sich jedes der drei Natriumionen (Na) mit einer Fettsäure und bildet drei Fettsäuresalze, im Wesentlichen drei Seifenmoleküle.
 Vereinfacht ausgedrückt: Wenn wir Fette oder Öle mit Natriumhydroxid (Lauge) kombinieren, verwandeln sie sich in Seife und Glycerin. Ein Blick auf die Grafik der Verseifungsreaktion zeigt, dass aus jedem Triglycerid ein Molekül Glycerin und drei Moleküle Seife entstehen.
Vereinfacht ausgedrückt: Wenn wir Fette oder Öle mit Natriumhydroxid (Lauge) kombinieren, verwandeln sie sich in Seife und Glycerin. Ein Blick auf die Grafik der Verseifungsreaktion zeigt, dass aus jedem Triglycerid ein Molekül Glycerin und drei Moleküle Seife entstehen.
Randbemerkung: Sie könnten auf die Begriffe Glycerin, Glycerin oder Glycerin stoßen synonym verwendet. Keine Sorge - sie beziehen sich alle auf die gleiche Verbindung, und es gibt keinen chemischen Unterschied zwischen ihnen. Der gebräuchliche Name für Glycerin ist tatsächlich Glycerin.
Das bei jeder Seifenherstellung entstehende Glycerin ist immer gleich. Glycerin, ein Feuchthaltemittel und Feuchtigkeitsspender, wird oft aus handelsüblicher Seife extrahiert, um die Seifenstücke härter zu machen. In handgemachter Seife bleiben jedoch alle wertvollen Inhaltsstoffe des Glycerins erhalten.
Die wahre Magie geschieht durch die drei Seifenmoleküle, jedes mit seiner einzigartigen Fettsäurezusammensetzung.
 Diese Reaktion ist nicht auf ein Triglyceridmolekül beschränkt, sie findet bei jedem einzelnen Molekül in einer Fett-/Ölmischung statt.
Diese Reaktion ist nicht auf ein Triglyceridmolekül beschränkt, sie findet bei jedem einzelnen Molekül in einer Fett-/Ölmischung statt.
Aus Abermillionen von Triglyceridmolekülen entstehen Abermillionen von Seifenmolekülen, von denen jedes dem fertigen Stück Seife seine besonderen Eigenschaften verleiht.
Auf den ersten Blick scheint die Verseifungsreaktion einfach: Man muss lediglich Öle und Lauge vermischen. Doch die Wissenschaft dahinter ist vielschichtiger.
Jedes Öl besteht aus verschiedenen Fettsäuren in unterschiedlichen Anteilen. Je nach Art der enthaltenen Fettsäuren hat die resultierende Seife ganz unterschiedliche Eigenschaften. Diese Komplexität macht die Seifenherstellung zu einer präzisen Wissenschaft, die ein tiefes Verständnis der Inhaltsstoffe und ihrer Wechselwirkungen erfordert.
Um außergewöhnliche Seifen herzustellen, ist eine durchdachte Mischung von Ölen mit unterschiedlichen Fettsäureprofilen unerlässlich.
Obwohl Hunderte von Fettsäuren bekannt sind, müssen Seifenhersteller vor allem die Eigenschaften von etwa acht Schlüsselfettsäuren verstehen. Die vier gesättigten Fettsäuren stammen hauptsächlich aus Ölen, die bei Raumtemperatur fest sind, und umfassen Myristin-, Laurin-, Palmitin- und Stearinsäure.
- Myristinsäure , die in Kokosnuss- und Palmkernölen enthalten ist, trägt zur Härte, Reinigung und Schaumbildung bei.
- Laurinsäure, die auch in Kokosnuss- und Palmkernölen vorkommt, trägt zu großen Blasen bei.
- Palmitinsäure , die in Palmöl und Kakaobutter enthalten ist, hilft dabei, ein Stück harte Seife mit stabilem, cremigem Schaum herzustellen.
- Stearinsäure, die in fester Butter wie Shea-, Mango- und Kakaobutter vorkommt, ist auch in Palmöl und Rindertalg enthalten. Diese Säure trägt auch zur Herstellung eines festen Seifenstücks mit stabilem Schaum bei.
Die vier ungesättigten Fettsäuren stammen aus Pflanzenölen, die bei Zimmertemperatur meist flüssig sind. Dazu zählen Ölsäure, Linolsäure, Linolensäure und Ricinolsäure.
- Ölsäure, die vor allem aus Olivenöl bekannt ist, aber auch in anderen Ölen wie Rapsöl vorkommt, verleiht Seife feuchtigkeitsspendende und pflegende Eigenschaften.
- Linolsäure, die am häufigsten in Sonnenblumen-, Distel- und Traubenkernöl vorkommt, hat außerdem feuchtigkeitsspendende und pflegende Eigenschaften.
- Linolensäure, die in Leinsamen-, Granatapfel- und einigen anderen Samenölen enthalten ist, verleiht der Haut feuchtigkeitsspendende und pflegende Eigenschaften.
-
Ricinolsäure, die nur in Rizinusöl vorkommt, verleiht Seife feuchtigkeitsspendende Eigenschaften. Vor allem aber sorgt sie für einen erstaunlich dichten, cremigen und schaumigen Schaum. Dank seiner einzigartigen Fettsäurezusammensetzung gibt es kein vergleichbares Öl.
Abschluss
Verseifung ist das Ergebnis einer Säure-Base-Reaktion. Wenn sich Säure und Base verbinden, neutralisieren sie sich gegenseitig und bilden ein Salz. Natriumhydroxid ist die Base , und die Säuren sind die Fettsäuren, aus denen die in Ölen und Butter enthaltenen Triglyceride bestehen.
Sobald wir die Öle ausgewählt und mit Natriumhydroxid und einer Flüssigkeit vermischt haben, verbinden sich die Moleküle, es kommt zu einer chemischen Reaktion namens Verseifung (siehe Abbildung unten) und es entsteht eine völlig andere Substanz – Seife und Glycerin.
 Sie müssen kein Chemieexperte sein, um Seife zu verwenden oder herzustellen, aber ein tieferes Verständnis der Wissenschaft dahinter kann das Erlebnis bereichern.
Sie müssen kein Chemieexperte sein, um Seife zu verwenden oder herzustellen, aber ein tieferes Verständnis der Wissenschaft dahinter kann das Erlebnis bereichern.
So wie ein erfahrener Koch weiß, dass die Beherrschung der Kochkunst sowohl Kreativität als auch ein Verständnis der zugrunde liegenden Lebensmittelchemie erfordert, erkennt ein erfahrener Seifenmacher, wie wichtig es ist, die Wissenschaft der Verseifung zu verstehen.
Während das Befolgen eines Rezepts zu guten Ergebnissen führen kann, erfordert wirklich außergewöhnliche handgemachte Seife eine sorgfältige Auswahl und Abstimmung der richtigen Fette und Öle. Durch das Verständnis der chemischen Wechselwirkung dieser Inhaltsstoffe mit der Lauge können Seifenhersteller hochwertige Seifenstücke herstellen, die die Haut pflegen und verwöhnen.
Jetzt ist es an der Zeit, die Bio-Seife zu finden, die perfekt zu Ihnen passt.

Enthält Naturseife Lauge? Schadet sie meiner Haut nicht?
Wie entsteht Schaum aus Naturseife?
Wie wir bei Chagrin Valley Seife herstellen
12 Gründe für die Verwendung von Naturseife
Sind alle handgemachten Seifen gleich?






